Assalamu'alaikum Wr Wb
Selamat Pagi / Siang
Semoga sehat selalu dimana pun kalian berada
Hari ini pertemuan pertama kita untuk membahas materi mengenai TERMOKIMIA.
Tuhan yang menciptakan langit dan bumi beserta isinya serta yang mengatur semua kehidupannya. Pada alam semesta ini terdapat energi yang dibutuhkan dan dihasilkan. Energi sangat penting dalam setiap aspek kehidupan kita sehari-hari. Semua makhluk hidup ciptaan-Nya membutuhkan energi. Energi merupakan sumber esensial bagi kehidupan manusia serta makhluk hidup lainnya. Sumber energi yang terbesar berasal dari energi matahari. Makanan yang kita makan merupakan sumber energi yang memberikan kekuatan kepada kita untuk dapat bekerja, belajar, dan beraktivitas lainnya. Setiap materi mengandung energi dalam bentuk energi potensial dan energi kinetik, kedua energi ini dinamakan energi internal (energi dalam). Ilmu yang mempelajari tentang energi dan perubahan energi dikenal dengan termodinamika. Cabang dari termodinamika yang mempelajari energi yang terlibat dalam reaksi kimia dikenal dengan termokimia.
Pada pertemuan pertama, kita akan :
- Mengamati demonstrasi reaksi yang membutuhkan kalor dan reaksi yang melepaskan kalor, misalnya reaksi logam Mg dengan larutan HCl dan pelarutan NH4Cl dalam air.
- Menganalisis data untuk membuat diagram tingkat energi suatu reaksi
💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧💧
Berikut adalah reaksi logam Mg dengan larutan HCl
Eksperimen Termokimia : Pelarut Garam dalam Air
Pernahkah kalian melihat kapur tohor yang disiram dengan air? Apa yang terjadi?
Jika kalian melihat secara langsung kapur tohor yang disiram dengan air, kalian akan dapat mengamati terbentuknya asap (gas) serta merasakan suhu di sekeliling kapur akan bertambah panas. Inilah yang dinamakan reaksi eksoterm, yaitu reaksi yang disertai pelepasan kalor dari sistem ke lingkungan.
Berkebalikan dengan reaksi eksoterm adalah reaksi endoterm, yaitu reaksi yang disertai penyerapan kalor dari sistem ke lingkungan. Reaksi ini dapat diamati saat kita melarutkan asam sitrat atau sitrun, yaitu bahan yang dipakai untuk memberikan rasa masam dalam pembuatan sirup dan manisan. Ketika asam sitrat dilarutkan dalam segelas air, kita akan merasakan bahwa suhu gelas berubah menjadi lebih dingin.
Dalam persamaan reaksi termokimia, jenis perubahan energi yang terjadi dapat kita lihat dari perubahan entalpinya (∆H). Reaksi eksoterm memiliki ∆H berharga negatif, sedangkan reaksi endoterm memiliki ∆H berharga positif.
Contoh:
Eksoterm: 2H2(g) + O2(g) → 2H2O(g) ∆H = -483,6 kJ
Endoterm: N2(g) + O2(g) → 2NO(g) ∆H = +180,5 kJ
DIAGRAM TINGKAT ENERGI
Salah satu cara untuk menunjukkan perubahan kalor/ entalpi yang terjadi dalam suatu reaksi kimia adalah dengan menggunakan diagram tingkat energi.
Dalam diagram tingkat energi, dituliskan reaktan dan besarnya entalpi yang dimiliki di awal reaksi serta produk dan besarnya entalpi di akhir reaksi. Selisih entalpi ini menunjukkan banyaknya perubahan entalpi yang terjadi.
Salah satu cara untuk menunjukkan perubahan kalor/ entalpi yang terjadi dalam suatu reaksi kimia adalah dengan menggunakan diagram tingkat energi.
Dalam diagram tingkat energi, dituliskan reaktan dan besarnya entalpi yang dimiliki di awal reaksi serta produk dan besarnya entalpi di akhir reaksi. Selisih entalpi ini menunjukkan banyaknya perubahan entalpi yang terjadi.
Diagram tingkat energi reaksi eksoterm
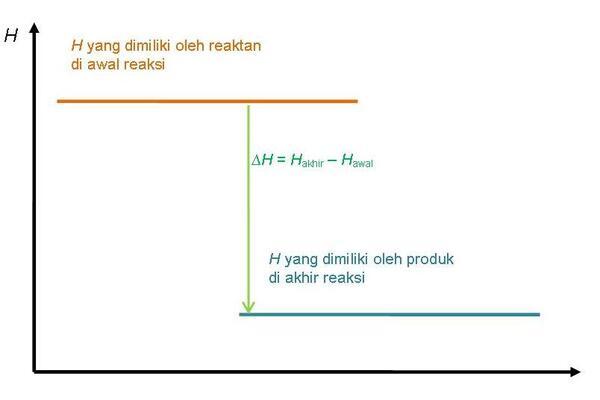
Pada diagram tingkat energi reaksi eksoterm, entalpi produk lebih rendah daripada entalpi reaktan karena sistem melepaskan kalor ke lingkungan.
Contoh:
Contoh:

Diagram tingkat energi reaksi endoterm
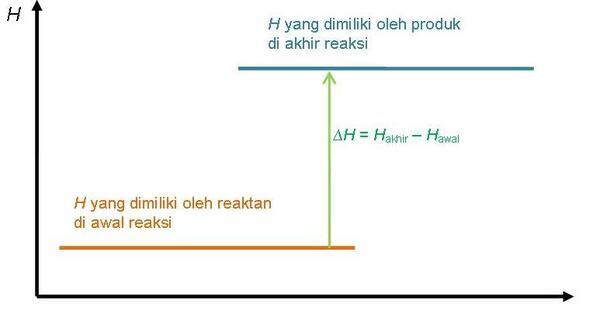
Pada diagram tingkat energi reaksi endoterm, entalpi produk lebih tinggi daripada entalpi reaktan karena sistem menyerap kalor dari lingkungan.
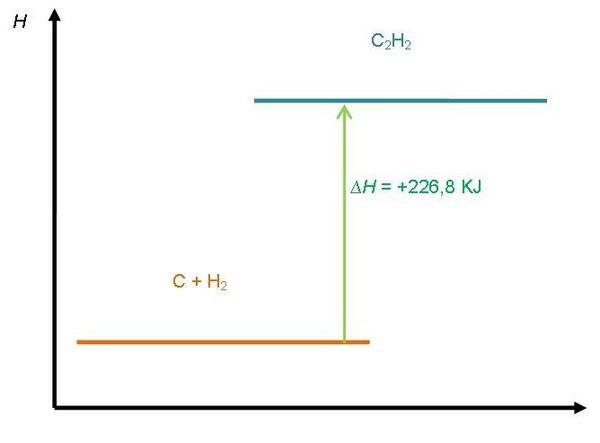
Contoh:
Referensi
Tidak ada komentar:
Posting Komentar
Silahkan mengajukan pertanyaan maupun saran dan kritik